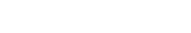郭江涛课题组发文解析人源钾氯共转运蛋白KCC2,3,4的冷冻电镜结构
2020年12月11日,浙565net必赢最新版首页官网基础565net必赢最新版首页官网郭江涛课题组在Science Advances杂志上发表论文Structures and an activation mechanism of human potassium-chloride cotransporters,报道人源KCC2、KCC3和KCC4的2.9-3.6 Å高分辨率冷冻电镜结构,揭示了KCC家族保守的N末端肽段自抑制现象,并提出了一种潜在的激活机制。
阳离子-氯离子共转运蛋白广泛分布于所有的生物界中,具有非常重要的生理功能,包括调节细胞体积,承担肾小管的重吸收作用,调节神经元细胞内部氯离子浓度和神经元的兴奋性。根据转运离子种类的不同,阳离子-氯离子共转运蛋白可以分为三类:钠钾氯共转运蛋白(NKCC)、钠氯共转运蛋白(NCC)和钾氯共转运蛋白(KCC)。人类基因组共编码 2 个钠钾氯共转运蛋白(NKCC1 和 NKCC2)、1 个钠氯共转运蛋白(NCC)和 4 个钾氯共转运蛋白(KCC1-4)。NKCC和NCC利用细胞膜两侧的Na+浓度梯度将细胞外的Na+、K+、Cl-或Na+、Cl-转运至细胞内;KCC则由细胞膜两侧的K+浓度梯度驱动将细胞内的K+和Cl-转运至细胞细胞外。阳离子-氯离子共转运蛋白的转运底物为 Na+、K+和 Cl-这些生命体内主要的阳离子和阴离子,故而它们在多项生命活动过程中发挥着重要的作用。
钾氯共转运蛋白KCC1-4介导K+和Cl-的耦合输出,在各种生理和病理过程中发挥着重要的作用。KCC2维持神经元细胞中氯离子的正常水平,在γ-氨基丁酸和甘氨酸介导的抑制性神经传递中发挥着重要作用。KCC2突变会导致抑制性神经元内Cl-浓度升高,抑制性神经元易于去极化而引发动作电位持续发放,诱导癫痫发作。KCC2的突变会导致两种类型的人类癫痫,一种是特发性全身性癫痫(Idiopathic Generalized Epilepsy,IGE),该类癫痫无脑部器质性或代谢性疾病表现, 与遗传因素密切相关并以全面性发作为发作类型;另一种是婴儿癫痫伴游走性局灶性发作(Epilepsy of Infancy with Migrating Focal Seizures,EIMFS),属于癫痫性脑病。而KCC3在上皮细胞中介导Cl-的跨膜转运,并参与脑脊液的产生。KCC3的功能异常会引起Andermann综合症,一种胼胝体发育不全的遗传性运动和感觉神经病。编码KCC3的SLC12A6是Andermann综合症的唯一致病基因,该疾病的临床表型的严重程度与基因的突变类型有关。KCC3的突变还可以引发耳聋以及神经退行性疾病。KCC家族成员的重要功能决定了它们将是治疗这些疾病的重要药物靶点,因此KCC家族成员的结构以及调节机制成为了该研究领域的热点问题。
本研究中,作者报道了人源KCC2、KCC3和KCC4的2.9-3.6 Å高分辨率冷冻电镜结构。KCC2-4具有相似的整体结构、结构域交换二聚体组装方式和向内构象。在该构象中,KCC2-4的二体组装主要是靠C末端结构域的二聚化来维持,跨膜结构域对二体组装贡献较少(图1)。在2.9 Å KCC4的高分辨率冷冻电镜结构中,进一步验证了之前该研究组在KCC1结构中确定的1个K+和2个Cl-结合位点。
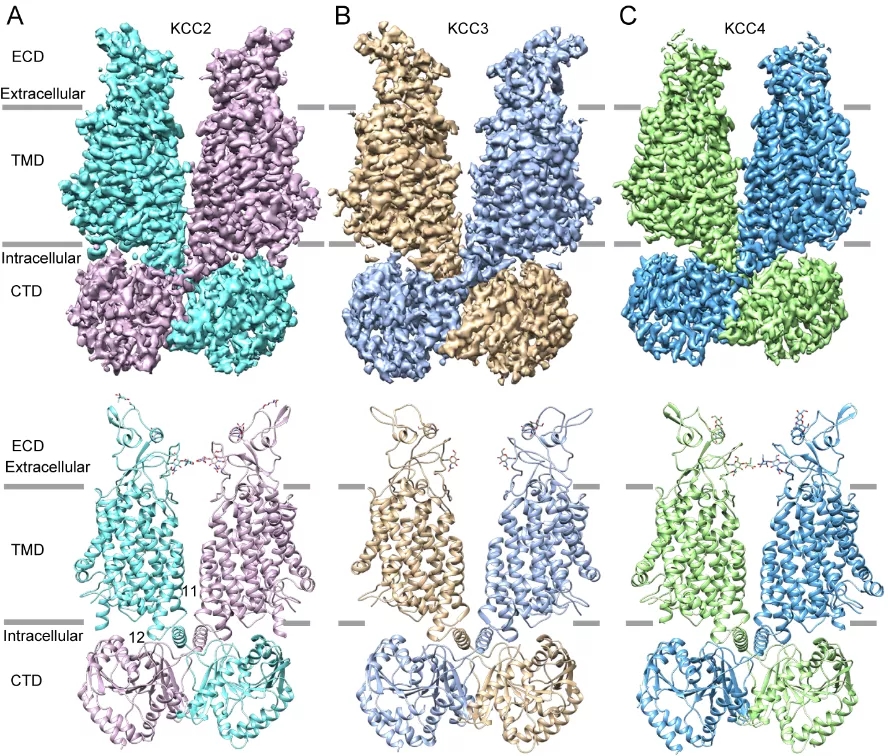
图1. KCC2,KCC3和KCC4的二聚体结构。
上:冷冻电镜密度图,下:卡通结构图。
KCC2-4的结构中,研究人员意外地发现,N末端肽段在面向胞质的腔中与跨膜结构域紧密结合,并与C末端结构域发生静电相互作用。结构分析发现,N末端肽段一方面阻断了底物离子的结合,另一方面限制了底物离子结合附近的构象变化,从而将KCC2-4锁定在自抑制状态(图2)。这一自抑制效应进一步通过离子转运活性实验进行了验证:当突变N末端肽段中与跨膜结构域作用的氨基酸时,KCC2的离子转运活性显著提升(图2)。
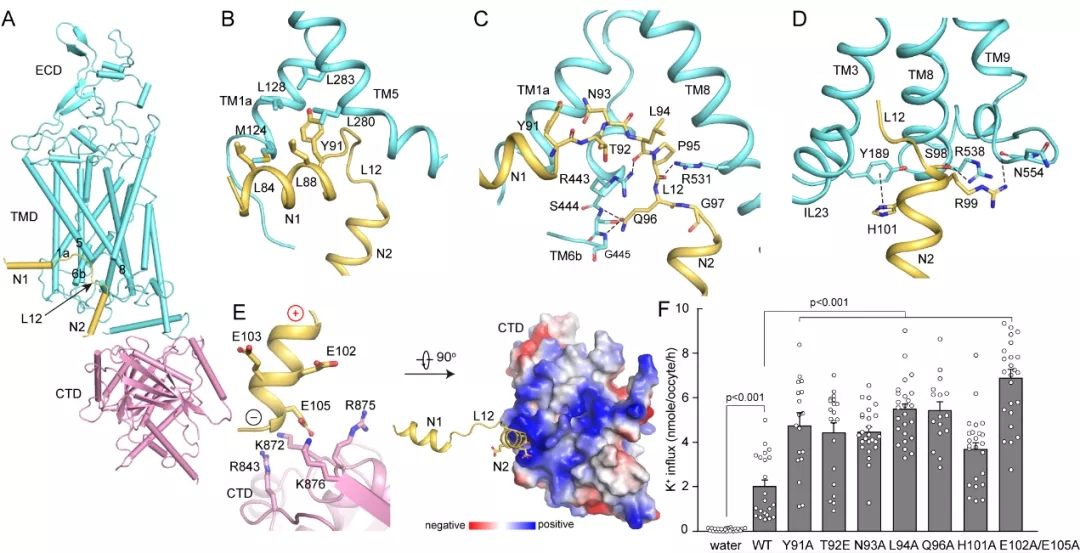
图2. KCC2的N末端自抑制。
(A) KCC2单个亚基的卡通侧视图。胞外结构域和跨膜结构域用青色表示,N末端多肽用黄色表示,C末端结构域用粉色表示。(B-E)N末端与跨膜螺旋和C末端结构域之间的相互作用;其中(E)显示N2和C末端结构域之间的静电相互作用,分别显示为卡通图(左)以及表面静电势模式(右)。(F)用注射KCC2野生型和突变体cRNA的非洲爪蟾卵母细胞来检测K+内流情况。
此外,在结构解析的过程中,研究人员发现KCC存在着C末端结构域运动的现象。当C末端结构域与跨膜结构域之间发生相对运动时,N末端肽段与C末端结构域的静电作用会被破坏,从而减弱了N末端肽段的结合。这暗示C末端结构域通过调节N末端肽段的自抑制作用来调节KCC家族成员的活性。研究人员通过与NKCC1的结构进行比较,进一步验证了激活状态下的KCC的C末端结构域的运动状态。
在此基础上,研究人员提出了KCC家族蛋白被激活的模型,在自抑制状态下,N末端肽段结合在面向胞质的腔中,并将转运蛋白锁定在向内构象中。C末端结构域与N末端肽段的相互作用,稳定这种自抑制状态。随着跨膜螺旋TM12的旋转和平移,N末端肽段与跨膜结构域和C末端结构域之间的相互作用被破坏,N末端肽段从面向胞质的腔中解离,KCC被激活(图3)。
图3. KCC的激活模型。
在自抑制状态下,N末端肽段结合在面向胞质的腔中,并将转运蛋白锁定在向内构象中。C末端结构域与N末端肽段相互作用,并稳定这种自抑制状态。随着跨膜螺旋TM12的旋转和平移,N末端肽段与C末端结构域之间的相互作用被破坏,N末端肽段从面向胞质的腔中解离,KCC被激活。
本研究解析了KCC家族完整的结构,并发现N末端肽段自抑制现象。在未来的研究中,需要进一步探讨体内生理状态下自抑制的调控机理。同时,这一自抑制现象为设计KCC激动剂提供了思路:设计别构调控分子,减弱N末端肽段的结合,从而起到激活KCC的效果,为开发抗癫痫药物提供结构基础。
本研究得到了自然科学基金面上项目、浙江省杰青和科技部重点研发计划的支持。浙565net必赢最新版首页官网基础565net必赢最新版首页官网解媛博士和常圣海博士为共同第一作者;浙565net必赢最新版首页官网基础565net必赢最新版首页官网郭江涛研究员、天津大学生命学院叶升教授和美国范德比尔特大学Eric Delpire为共同通讯作者。
郭江涛课题组一直致力于癫痫相关的膜蛋白的结构和调控机理研究。2019年10月25日,郭江涛课题组在Science杂志上发表研究论文Cryo-EM structures of the human cation-chloride cotransporter KCC1,在国际上率先报道人源KCC1的结构,揭示了KCC家族的结构和离子结合位点,为进一步揭示钾氯共转运机理提供了基础。2020年9月3日,郭江涛课题组在Cell Research上发表研究论文Molecular basis for ligand activation of the human KCNQ2 channel,在国际上首次报道人源钾通道KCNQ2的冷冻电镜结构,解析了抗癫痫药瑞替加滨与KCNQ2复合物的结构,揭示了其激活机理。这些系统性的结构生物学研究为揭示癫痫病的发病机理提供了线索,也为开发抗癫痫药物打下了坚实的基础。
原文链接:https://advances.sciencemag.org/content/6/50/eabc5883