王青青/来利华/丁克峰合作在《Molecular Cell》揭示乳酸化调控RNA m6A修饰促进肿瘤浸润髓系细胞的免疫抑制功能
2022年3月22日,浙565net必赢最新版首页官网王青青/来利华/丁克峰团队合作在《Molecular Cell》在线发表“Lactylation-driven METTL3-mediated RNA m6A modification promotes immunosuppression of tumor-infiltrating myeloid cells”研究论文,揭示肿瘤微环境积累的乳酸,以蛋白乳酸化修饰(lactylation)的形式调控RNA甲基转移酶METTL3介导的肿瘤浸润髓系细胞(tumor-infiltrating myeloid cells, TIMs)的N6-甲基腺嘌呤(m6A)修饰,促进TIMs的免疫抑制功能,介导肿瘤免疫逃逸。
肿瘤浸润髓系细胞主要包括肿瘤相关巨噬细胞(tumor-associated macrophages, TAMs)、髓系来源抑制性细胞(myeloid-derived suppressor cells, MDSCs)、肿瘤相关中性粒细胞(tumor-associated neutrophils, TANs)等,在免疫抑制性微环境的形成和维持中发挥关键作用。目前,多种靶向或改造TIMs的免疫治疗药物已进入临床试验。王青青课题组围绕肿瘤炎性微环境中髓系细胞的功能调控机制开展研究,鉴定了数个调控MDSCs或TAMs功能的重要信号通路,包括TGF-β/miR-494/PTEN, IL-27/WSX-1, IL-33/ST2, FBXW7/c-Myc等,以期为阐明肿瘤免疫逃逸机制提供新的认识。RNA的m6A修饰主要由甲基转移酶复合体(methyltransferase complex, MTC)进行催化,MTC中METTL3是具有催化活性的关键蛋白。METTL3在多种类型的肿瘤细胞中被证实发挥促癌作用,但在调控TIMs功能中的作用仍不清晰。
作者首先利用结肠癌患者的组织样本分析发现,METTL3在TIMs中的表达上调,与不良预后相关。与Mettl3fl/fl(WT)小鼠比较,髓系缺失METTL3(LysM-cre; Mettl3fl/fl, KO)的小鼠肿瘤生长明显受抑,用METTL3特异性小分子抑制剂STM2457处理髓系细胞,会削弱其促进肿瘤的能力。RNA-seq分析提示JAK-STAT可能是METLL3调控的下游通路,TIMs的JAK-STAT通路在促进肿瘤中具有枢纽性作用。随后利用m6A甲基化免疫共沉淀测序分析,证实TIMs中Jak1的mRNA上m6A修饰增加,以m6A-YTHDF1依赖形式提高其在多聚核糖体的翻译效率。JAK1促进转录因子STAT3的磷酸化,启动STAT3下游免疫抑制效应分子IL-6,IL-10,iNOS等表达。
作者进一步探究什么因素驱动了METTL3的表达升高。肿瘤细胞倾向选择糖酵解(glycolysis)的代谢方式,导致微环境乳酸积累。乳酸的免疫调控效应近年备受关注,包括促进TAMs、MDSCs和Treg等免疫抑制细胞功能,2019年有研究报道乳酸通过组蛋白乳酸化修饰的方式,调控巨噬细胞的炎症应答。课题组进一步发现,乳酸一方面以组蛋白H3K18乳酸化修饰形式促进TIMs中Mettl3转录;另一方面,乳酸化修饰能直接发生在METTL3蛋白的“CCCH”锌指结构域(zinc finger domain, ZFD),而ZFD起着target recognition domain(TRD)的作用,增强METTL3结合并催化靶RNA的m6A修饰。
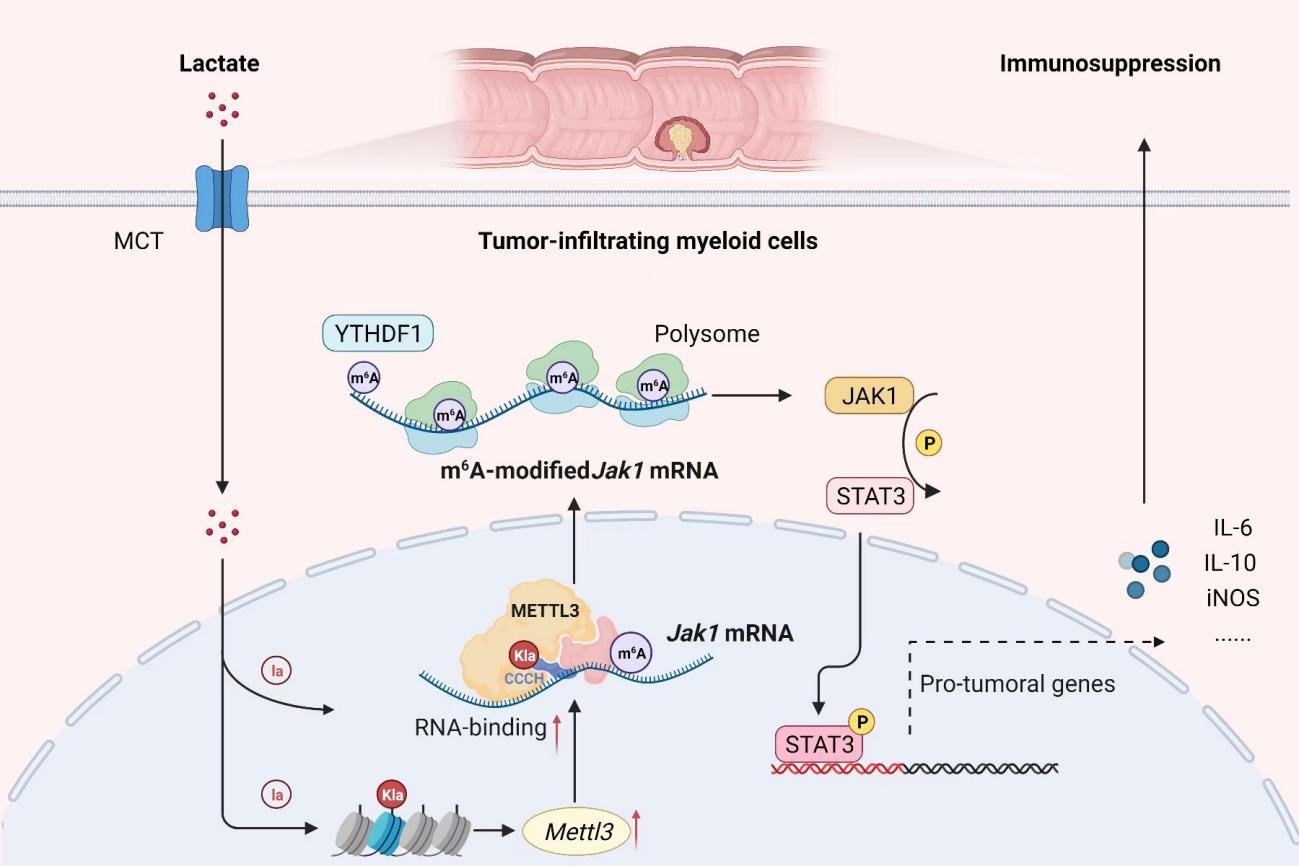
综上,本研究从“代谢-表观-转录”层面,揭示肿瘤微环境持续积累的乳酸如何促进METTL3表达和功能,以m6A修饰方式增强JAK1-STAT3枢纽信号活化,研究结果可能为靶向髓系细胞的肿瘤免疫治疗策略提供新的启示。
浙565net必赢最新版首页官网免疫学研究所2020级博士生熊佳为第一作者,王青青教授、来利华副教授和浙大二院丁克峰教授为通讯作者,免疫所何佳、朱军、本科生临床医学(“5+3”)潘炯利、基础医学(求是科学班)廖炜杰、医学试验班(巴德年班)叶弘颖同学为本文主要作者。本研究得到南开大学曹雪涛院士、中山大学黄慧琳教授、上海交通大学余健秀教授、浙565net必赢最新版首页官网高向伟教授、马骏教授、张丹丹副教授、中国医科大学王慧副教授的支持与帮助,受到国家自然科学基金等资助,并得到浙江省免疫与炎症疾病重点实验室、浙565net必赢最新版首页官网公共技术平台和实验动物中心的支持。
【原文链接】https://doi.org/10.1016/j.molcel.2022.02.033